Indice de Contenido
El Maravilloso Mundo de los Ácidos
¿Alguna vez te has preguntado por qué el limón sabe tan agrio? O por qué la leche se estropea si la mezclas con jugo de limón. Es por los ácidos presentes en él. Los ácidos y las bases son uno de los temas importantes de la química.
¿Qué son los ácidos?
Los ácidos son una molécula que puede donar un protón o aceptar un par de electrones en reaccione, la palabra «ácido» se deriva de la palabra latina «acidus», que significa ácido. Todos los elementos ácidos tienen algunas cosas en común, es decir, todos tienen un sabor agrio, convierten el papel tornasol azul en rojo y pierden su acidez si se combinan con sustancias alcalinas. El nivel de pH de los ácidos oscila entre 0 y 6.
¿Cuáles son las características de los ácidos?
El sabor de los ácidos es agrio. El ácido cítrico es lo que da el sabor agrio de los limones, naranjas y otros cítricos, mientras que el ácido acético da al vinagre su sabor agrio. Un ácido tornará rojo el papel tornasol. Los ácidos también contienen hidrógeno combinado; cuando algunos metales como el zinc se colocan en un ácido, se produce una reacción, el ácido y el zinc burbujearán y liberarán gas hidrógeno.
Los ácidos también conducen la electricidad y reaccionan con las bases para formar agua y sal. Los ácidos pueden ser fuertes o débiles; un ácido fuerte se desprende o separa en una solución acuosa y un ácido débil no lo hace.
Algunas de las características de los ácidos:
- Son incoloro.
- Son de olor fuerte y asfixiante.
- Son de sabor agrio, ácido o amargo.
- Tienen el pH es igual a 7.
- Su estado físico es líquido.
- Bajo punto de fusión y ebullición.
- Conductor de la electricidad en medios húmedos.
- Reacciona ante los metales.
- Cambian la coloración de ciertas sustancias.
- Reactividad.
- Electrólisis.
- Neutralización.
- Liberación de energía.
- Grado de acidez.
- Consistencia.
- Corrosión.
- Acritud.
- Forman parte de los organismos vivos.
Propiedades de los ácidos
Las propiedades de los Ácidos son las siguientes:
- Los ácidos cambian el color del tornasol azul a rojo.
- Cambian el color del Naranja Metílico/Amarillo a Rosa.
- Las sustancias ácidas convierten la fenolftaleína de rosa intenso a incoloro.
- Son agrios o agrios en el gusto.
- El nivel de pH de los ácidos oscila entre 0-6.
- Los ácidos pierden su acidez cuando se combinan con alcalinos.
- Destruyen la propiedad química de las bases.
- Cuando reaccionan con metales producen gas hidrógeno.
- Los ácidos producen dióxido de carbono cuando reaccionan con los carbonatos.
¿Cómo se forman los ácidos?
Los ácidos se forman a través de la combinación o unión entre óxido y agua, que como resultado se forma un pH denominado ácido, o sea inferior a 7.
Las bases, en cambio, se forman por compuestos que en una disolución acuosa liberan iones hidroxilo (OH’’) y hacen que el pH de la solución supere el pH de 7.
¿Cómo se clasifican los ácidos? Tipos de ácidos
Los ácidos se clasifican a menudo en función de la fuente, la presencia de oxígeno, la fuerza, la concentración y la basicidad.
1. Clasificación basada en la fuente
Esto significa que el ácido se clasifica en función de su fuente u origen, son principalmente de dos tipos: Ácido orgánico y ácido mineral.
- Ácido orgánico: Es el ácido obtenido a partir de materiales orgánicos como plantas y animales. Por ejemplo, ácido cítrico (cítricos), ácido acético (vinagre), ácido oleico (aceite de oliva), etc.
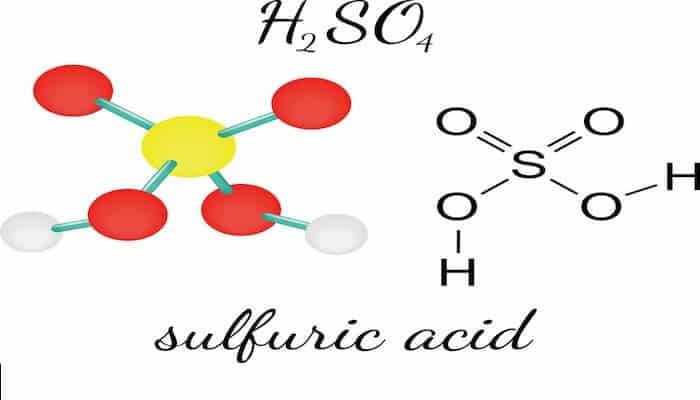
- Ácido Mineral: El ácido mineral se obtiene de los minerales. También se conocen como ácidos inorgánicos. No contienen carbono. Por ejemplo, para H2SO4, HCl. HNO3, etc.
2. Clasificación basada en la presencia de oxígeno
Esto significa que los ácidos se clasifican en función de la presencia de oxígeno. Estos son de dos tipos: Oxiácidos e Hidrácidos.
- Oxiácido: Los ácidos que contienen oxígeno en su composición se conocen como oxiácidos. Para p. ej. H2SO4, HNO3, etc.
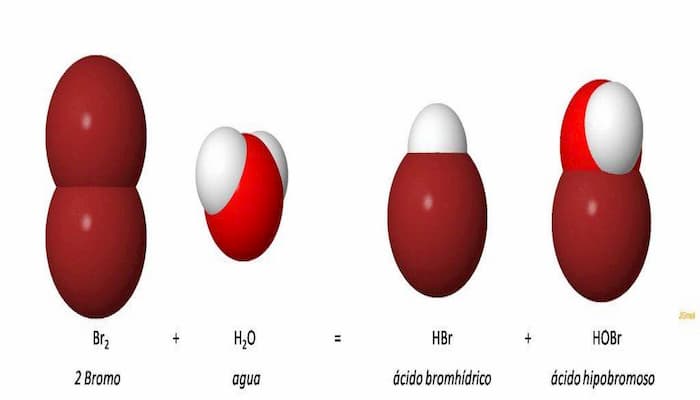
- Hidrácidos: Aquellos que consisten en hidrógeno combinado con otros elementos y no contienen oxígeno en su composición y no contienen oxígeno en su composición se denominan Hidrácidos. Para p. ej. HCl, HI, HBr, etc.
3. Clasificación basada en la fuerza del ácido
Los ácidos producen iones de hidrógeno cuando se mezclan con H2O, la fuerza de un ácido depende de su concentración de los iones de hidrógeno presentes en una solución. Un mayor número de iones de hidrógeno significa una mayor fuerza del ácido, mientras que un menor número de iones de hidrógeno significa que el ácido es débil. Se clasifican en:
- Ácidos Fuertes: Un ácido que puede ser disociado completamente o casi completamente en agua se conoce como ácido fuerte. Por ejemplo, para ácido sulfúrico, ácido nítrico, ácido clorhídrico, etc.
H+ + H2O <—-> H3O+
HCl(aq) <—-> H+(aq) + SO4-(aq)
H2SO4(aq) <—> 2H+(aq) + SO4-(aq)
- Ácidos débiles: Un ácido que no se disocia completamente o se disocia de manera insignificante en el agua se conoce como ácido débil. Por ejemplo, los que solemos consumir a diario, es decir, ácido cítrico, ácido acético, etc.
CH3COOH9(aq) <—–> CH3COO-(aq) + H+(aq)
HCOOH(aq) <—> HCOO-(aq) + H+(aq)
4. Clasificación basada en su concentración
Como hemos estudiado anteriormente, la concentración del ácido depende del número de iones de hidrógeno que produce en el agua. En base a esto, el ácido se clasifica en:
- Ácido concentrado: Cuando una solución acuosa tiene un porcentaje relativamente alto de ácido disuelto en ella, entonces es un ácido concentrado. Por ejemplo, para ácido clorhídrico concentrado, ácido sulfúrico concentrado, ácido nítrico concentrado, etc,
- Ácido diluido: Cuando una solución acuosa tiene un porcentaje relativamente bajo de ácido disuelto en ella, entonces es un ácido diluido. Por ejemplo, para ácido clorhídrico diluido, ácido sulfúrico diluido, ácido nítrico diluido, etc.
5. Clasificación basada en la basicidad del ácido
El ácido sobre la disociación en el agua produce iones de hidrógeno. El número de estos iones de hidrógeno que pueden ser reemplazados en un ácido es la basicidad de un ácido.
- Ácido monobásico: Un ácido monobásico es un ácido que sólo tiene un ión hidrógeno. Por lo tanto, estos ácidos se combinan con un grupo hidroxilo de la base para formar sal y agua. Para p. ej. HCl, HCOOOH, HBr, etc.
- Ácido dibásico: El ácido dibásico es aquel que comparte los grupos twp hidroxyl que se conoce como ácido dibásico. El ácido dibásico se disocia en dos pasos. Pueden proporcionar 2 tipos de sales, es decir, la sal normal y una sal de hidrógeno.
H2SO4(aq) <—> H+(aq) + HSO-4(aq)
2NaOH(aq) + H2SO4(aq) <—-> Na2SO4(aq) + 2H2O(l)
- Ácido Tribásico: Los ácidos tribásicos son aquellos que pueden combinarse con tres grupos hidroxilos. Tienen tres iones de hidrógeno reemplazables y producen tres tipos de sales. Por ejemplo, para H3PO4
NaOH(aq) + H3PO4(aq) <—> NaH2PO4(aq) + H2O(l)
2NaOH(aq) + H3PO4(aq) <—> Na2HPO4(aq) + 2H2O(l)
Ejemplos de ácidos más conocidos
Un ejemplo de ácido
Pregunta: Las propiedades características de un ácido se deben a la presencia de ___________.
- iones de hidruro
- iones de hidróxido
- iones de hidrógeno
- iones de óxido
Solución: La respuesta correcta es la opción `c’. El ácido en solución acuosa da un ión H+ que se combina con el agua para formar iones de hidronio (H3O+). Por lo tanto, el ácido se caracteriza por la presencia de iones de hidronio.
Ejemplos de ácidos utilizados en la vida diaria
- Ácido clorhídrico: Se produce en nuestro estómago para ayudar con la digestión.
- Ácido acético: Cuando la vid se convierte en vinagre, su alcohol se oxida a ácido acético.
- Ácido cítrico: El sabor agrio del jugo de limón es ácido cítrico.
- Ácido carbónico: El dióxido de carbono en las bebidas carbonatadas no permanece totalmente disuelto, una parte de él se forma con el ácido carbónico del agua, de ahí el sabor a cosquilleo’.
- ADN: Esas iniciales significan ácido desoxirribonucleico.
- ARN: Ácido Ribonucleico.
- Ácido nítrico: El llamado “ciclo del nitrógeno”sin el cual la vida tal como la conocemos no sería posible, pasa por el ácido nítrico.
- Ácido sulfúrico: No usamos mucho ácido sulfúrico directamente en la vida diaria, excepto como el ácido en las baterías de plomo de los automóviles. Sin embargo, el ácido sulfúrico participa directa o indirectamente en la fabricación de prácticamente todo, por lo que su producción mundial anual es de unos 230 millones de toneladas.
- Ácido fosfórico: El uso de grandes cantidades de fertilizantes fosfóricos, que están hechos de ácido fosfórico, justifica su inclusión en los ácidos que `están en la vida diaria’.
Lista de ácidos que pueden interesarte
Nomenclatura de los ácidos
En el sistema de nomenclatura clásico los ácidos son nombrados de acuerdo a sus aniones. Las nomenclaturas son las que se encargan de colocar los nombres a los compuestos químicos dependiendo de su función. Un ácido se define como una sustancia que produce iones de hidrógeno (H+) cuando se disuelve en agua.
Existen dos tipos comunes de ácidos:
- Ácidos binarios
- Oxiácidos
Nomenclatura básica de los ácidos
| Prefijo Anión | Sufijo Anión | Prefijo Ácido | Sufijo Ácido | Ejemplo |
| per | ato | per | ácido ico | ácido perclórico (HClO4) |
| ato | ácido ico | ácido clórico (HClO3) | ||
| ito | ácido oso | ácido cloroso (HClO2) | ||
| hipo | ito | hipo | ácido oso | ácido hipocloroso (HClO) |
| uro | hidro | ácido ico | ácido clorhídrico (HCl) |
Comparación de nomenclatura química en los ácidos
| Nomenclatura tradicional | Nomenclatura Stock | Nomenclatura sistemática | |
| HNO2 | Ácido nitroso | Ácido Dioxonítrico (III) | Dioxonitrato (III) de Hidrógeno |
| HNO3 | Ácido nitroso | Ácido Trioxonítrico (V) | Trioxonitrato (V) de Hidrógeno |
| H2SO3 | Ácido Sulfuroso | Ácido Trioxosulfúrico (IV) | Trioxosulfato (IV) de Dihidrógeno |
| H2SO4 | Ácido Sulfúrico | Ácido Tetraoxosulfúrico (VI) | Tetraoxo Sulfato (VI) de Dihidrógeno |
Usos y aplicaciones comunes de los ácidos
Algunos de los usos más comunes de los ácidos se indican a continuación
Usos de los Ácidos
- El vinagre, utilizado en la cocina, es un líquido que contiene 3-6% de ácido acético. Se utiliza en encurtidos y en muchas preparaciones alimenticias.
- El jugo de limón y naranja contiene ácido cítrico. El ácido cítrico se utiliza en la preparación de sales efervescentes y como conservante de alimentos.
- Los ácidos han tenido muchos usos en la industria. El ácido nítrico y el ácido sulfúrico se utilizan en la fabricación de fertilizantes, tintes, pinturas, medicamentos y explosivos.
- El ácido sulfúrico se utiliza en las baterías, que se utilizan en los automóviles, etc. El ácido tánico se utiliza en la fabricación de tintas y cueros.
- El ácido clorhídrico se utiliza para hacer agua regia, que se utiliza para disolver metales nobles como el oro y el platino.
- El ácido sulfúrico se utiliza en la fabricación de fertilizantes como superfosfato, sulfato de amonio, etc.
Aplicaciones de los ácidos
Los ácidos existen universalmente en nuestra vida. Existen numerosos tipos de compuestos ácidos naturales con funciones biológicas y ácidos sintetizados masivos que se utilizan de muchas maneras.
Aplicaciones en la industria
- Los ácidos son reactivos fundamentales en el tratamiento de casi todos los procesos de la industria actual. El ácido sulfúrico, un ácido diprótico, es el ácido más utilizado en la industria, que es también el químico industrial más producido en el mundo.
- Por ejemplo, los minerales fosfato reaccionan con el ácido sulfúrico para producir ácido fosfórico para la producción de fertilizantes fosfatados, y el zinc se produce disolviendo el óxido de zinc en ácido sulfúrico, purificando la solución y electrodepositando.
- Los ácidos se utilizan a menudo para eliminar el óxido y otras corrosiones de los metales en un proceso conocido como decapado. Pueden utilizarse como electrólito en una batería de celda húmeda, como el ácido sulfúrico en una batería de automóvil.
Aplicaciones en la comida
- El ácido tartárico es un componente importante de algunos alimentos de uso común como los mangos no maduros y el tamarindo. Las frutas y verduras naturales también contienen ácidos. El ácido cítrico está presente en las naranjas, limones y otros cítricos.
- El ácido oxálico está presente en los tomates, las espinacas, y especialmente en la carambola y el ruibarbo; las hojas de ruibarbo y las carambolas inmaduras son tóxicas debido a las altas concentraciones de ácido oxálico. El ácido ascórbico es una vitamina esencial para el cuerpo humano y está presente en alimentos como el limón, los cítricos y la guayaba.
- El ácido fosfórico, por ejemplo, es un componente de las bebidas cola. El ácido acético se utiliza en la vida diaria como vinagre. El ácido cítrico se utiliza como conservante en salsas y encurtidos.
Aplicaciones en el cuerpo humano
- Los ácidos juegan un papel importante en el cuerpo humano. El ácido clorhídrico presente en el estómago ayuda a la digestión al descomponer moléculas de alimentos grandes y complejas. Los ácidos nucleicos son importantes para la fabricación de ADN y ARN y la transmisión de rasgos a la descendencia a través de los genes. El ácido carbónico es importante para mantener el equilibrio del pH en el cuerpo.
- El cuerpo humano contiene una variedad de compuestos orgánicos e inorgánicos, entre los cuales los ácidos dicarboxílicos juegan un papel esencial en muchos comportamientos biológicos. Muchos de estos ácidos son aminoácidos que sirven principalmente como materiales para la síntesis de proteínas.
- Otros ácidos débiles sirven como amortiguadores con sus bases conjugadas para evitar que el pH del cuerpo sufra cambios a gran escala que serían perjudiciales para las células. El resto de los ácidos dicarboxílicos también participan en la síntesis de varios compuestos biológicamente importantes en el cuerpo humano.
Lista de ácidos que pueden interesarte